近日,我校化学与材料学院陈填烽教授团队设计了一系列钌 (Ru) 多吡啶基配合物,探究其在促进NK细胞杀伤能力及重塑免疫微环境方面的作用。该研究为在临床上开发更有效的过继细胞转移疗法提供了重要信息。最新研究成果“Ruthenium complexes boost NK cell immunotherapy via sensitizing triple-negative breast cancer and shaping immuno-microenvironment”在Biomaterials杂志(IF=12.479)发表(暨南大学为本文唯一完成单位)。论文第一作者为我校化学与材料学院的博士生陈奇和暨南大学附属第一医院的贺利贞研究员,陈填烽教授和许利耕教授为该文章的共同通讯作者。

开发安全有效的肿瘤免疫联合治疗新策略具有极其重要的临床意义。作为典型的过继性免疫细胞疗法,自然杀伤细胞(NK)介导的免疫疗法具有其独特优势,如MHC非限制性杀伤能力及其对获得性免疫反应的有效调控等,在临床肿瘤治疗中显示出良好的应用前景。然而,肿瘤细胞的耐受性和免疫逃逸以及肿瘤极其复杂的微环境等大大削弱了其疗效。近年来,大量临床证据表明,联合治疗可能是提高单一治疗疗效的有效策略。然而,如何合理设计化疗药物,实现其与NK细胞治疗的有机协同仍是临床肿瘤治疗面临的关键挑战。
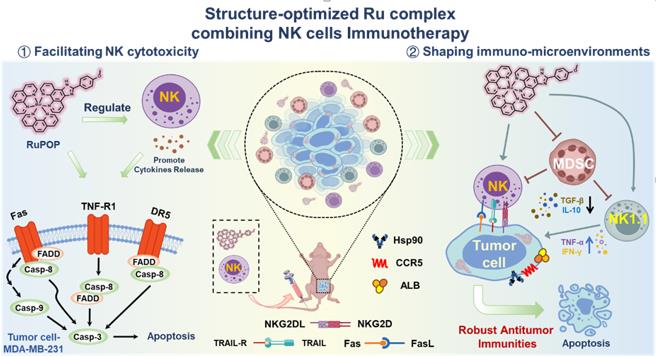
本文通过利用二亚胺基团改变Ru配合物的侧链,成功设计并研究了多种Ru配合物在协同NK细胞治疗方面的潜在应用。有趣的是,我们发现化学结构极大地决定了钌基衍生物的活性。在这些衍生物中,只有Ru-苯基三联吡啶复合物(RuPOP)可以有效调节肿瘤细胞中的免疫抑制相关蛋白和维持肿瘤细胞功能的重要蛋白质,从而在致敏三阴性乳腺癌细胞(MDA-MB-231),有效促进癌症患者来源的NK细胞杀伤作用方面显示出其独特优势。一方面,RuPOP本身可以在相对高浓度下有效杀伤肿瘤细胞并诱发免疫原性死亡,同时对正常细胞表现出低毒性。另一方面,RuPOP即使在较低浓度下预处理肿瘤细胞亦可有效提高乳腺癌细胞对癌症患者来源 NK 细胞的敏感性。一系列结果表明,RuPOP预处理联合NK 细胞治疗主要通过诱导大量ROS生成、激活多种凋亡相关受体,并上调 NKG2D 配体有效增强 NK 细胞与肿瘤细胞之间的相互作用,最终触发 caspase 3 依赖性的细胞凋亡。此外,大量动物实验结果表明,RuPOP联合NK细胞治疗可有效促进人源NK细胞在肿瘤中的蓄积、高效诱导免疫原性细胞死亡、激活小鼠NK细胞且抑制髓源性免疫抑制细胞(MDSC)在肿瘤内的浸润等,诱导强有效的抗肿瘤免疫反应抑制乳腺癌肿瘤的恶性进展。本研究为合理设计安全有效的化疗药物实现与NK细胞免疫治疗的有机协同提供了重要启示,也为临床开发更加高效的过继性免疫细胞治疗新策略提供了重要信息。相关工作得到了该研究得到国家自然科学基金、广东省高校创新团队项目、广东省自然科学重大专项等多个项目的资助。
暨南大学化学与材料学院陈填烽教授:一直致力于以临床问题为导向的化学创新药物设计与诊疗应用研究,获得万人计划青年拔尖人才项目、国家863计划、国家自然科学基金项目、国家科技支撑计划及广东省自然科学杰出青年基金等项目的资助。先后入选了教育部新世纪优秀人才支持计划(2010)、广东省高校“千百十工程”省级培养人才(2012),国家863青年科学家(2013)、广东省杰出青年基金项目(2013)、霍英东青年教师奖(2014)及万人计划青年拔尖人才(2015)。担任Journal of Nanobiotechnology副主编、Nano Research、Smart Materials in Medicine杂志编委。研究获得了国家万人计划青年拔尖人才项目、国家863计划、国家自然科学基金及广东省自然科学基金等的资助和支持。以通讯作者在Matter, Sci. Adv., J. Am. Chem. Soc., Angew. Chem. Int. Ed., Adv. Funct. Mater. 及Biomaterials等国际主流期刊发表论文超过200篇,封面论文38篇,h-index 64,申报中国专利90项,实现技术成果转化12项,以第一完成人获得2020年高等学校科学研究优秀成果奖技术发明二等奖、2020年中国抗癌协会科技二等奖、2018年中华医学科技奖青年科技奖及2018广东省自然科学二等奖等多项科技奖励。
暨南大学化学与材料学院许利耕教授:2021年科睿唯安全球高被引科学家(交叉学科),广东省自然科学杰出青年基金获得者。近年来,在精确调控纳米材料与免疫系统的相互作用,开发基于纳米材料的肿瘤免疫治疗新策略方面开展了一系列研究,已在国际学术期刊上发表SCI论文50余篇,文章他引次数 >6800,H-index为32。其中,以第一作者和通讯作者身份在Nat. Commun., Adv. Mater., Nano Lett., ACS Nano, Adv. Funct. Mater.和Nano Today等国际权威期刊发表SCI论文20篇(1区文章16篇),影响因子大于10的11篇,1篇被MaterialsViews China进行了亮点报道,1篇入选“2016 Hot Articles in Nanoscale”,5篇入选ESI高被引论文。主编出版纳米生物学本科实验教材(科学出版社“十三五”规划教材),参编中文学术专著 (科学出版社)1部,英文学术专著 (Wiley出版社)2部,授权国家发明专利4项。主持NSFC青年科学基金和面上项目、广东省自然科学杰出青年基金、广东省教育厅重点项目、广州市基础与应用基础研究项目、中央高校军工培育项目和中科院纳米生物效应与安全性重点实验室开放课题各1项。应邀担任Nature Communications, Advanced Materials, ACS Nano等20多个国际著名期刊审稿人,担任广东省自然科学基金和高层次人才项目、河南省科技奖励和国家自然科学基金项目函评专家。
论文信息:
Chen Q, He L, Li X, Xu L, Chen T. Ruthenium complexes boost NK cell immunotherapy via sensitizing triple-negative breast cancer and shaping immuno-microenvironment. Biomaterials. Doi: 10.1016/j.biomaterials.2022.121371.
论文链接:https://www.sciencedirect.com/science/article/pii/S0142961222000102#bib1


