近日,本课题组在基于肿瘤免疫治疗的纳米药物设计上获得新突破,在国际著名期刊《Nanoscale》杂志(2020,3, 4705-4727,杂志影响因子为6.895)发表了题为“Nanomedicine-based cancer immunotherapiesdeveloped by reprogramming tumor-associatedmacrophages”的研究成果。暨南大学为该研究的唯一完成单位,硕士生李晓影和郭晓明博士为本论文共同第一作者,陈填烽教授和贺利贞研究员为论文的通讯作者。
肿瘤微环境是由肿瘤细胞外基质、成纤维细胞、血管和免疫细胞组成的复杂生态系统,通过分泌多种生长因子、水解酶和炎症因子促进肿瘤的发展。肿瘤相关巨噬细胞(TAMs)是TME中数量最多的免疫细胞,对肿瘤的生长、侵袭、转移、血管生成和免疫抑制具有“双刃剑”作用。在TME中不同细胞因子的调节下,TAMs可以在杀瘤的M1样巨噬细胞和促肿瘤的M2样巨噬细胞之间进行表型转换。
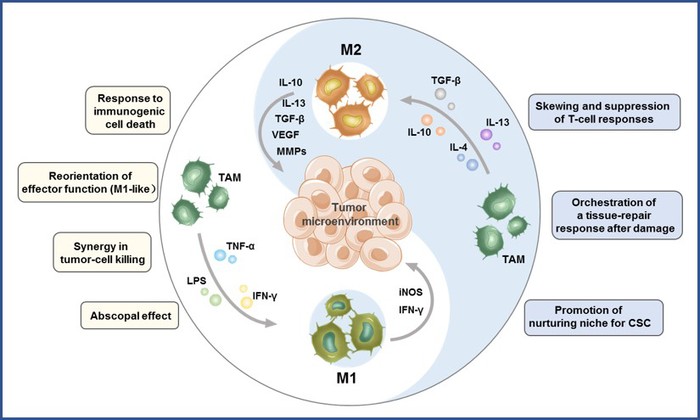
图1 巨噬细胞极化及其在肿瘤发生和发展中的作用
TAMs极化表明,科学家可以利用这一特性设计针对这一调节的药物,作为一种有希望的免疫治疗策略,以提高肿瘤治疗效率。因此,该团队总结了TAMs在肿瘤发生中的意义并综述了通过各种途径抑制肿瘤区域M2样巨噬细胞比例的纳米粒子。其中途径大致可以分为3种,包括通过纳米药物通过杀死TAMs,从根源上降低M2样巨噬细胞产生的机会;或是抑制肿瘤区域对巨噬细胞募集作用,减少巨噬细胞转化为M2样的因素;还可以利用纳米粒子将其从促肿瘤的M2样巨噬细胞重新极化为抗肿瘤的M1样巨噬细胞来靶向TAMs。这一综述不仅将为理解TAMs及其在癌症治疗中的作用提供背景科学信息,而且有助于科学家设计基于肿瘤TAMs的纳米药物,从而帮助实现更好的肿瘤临床治疗结果。
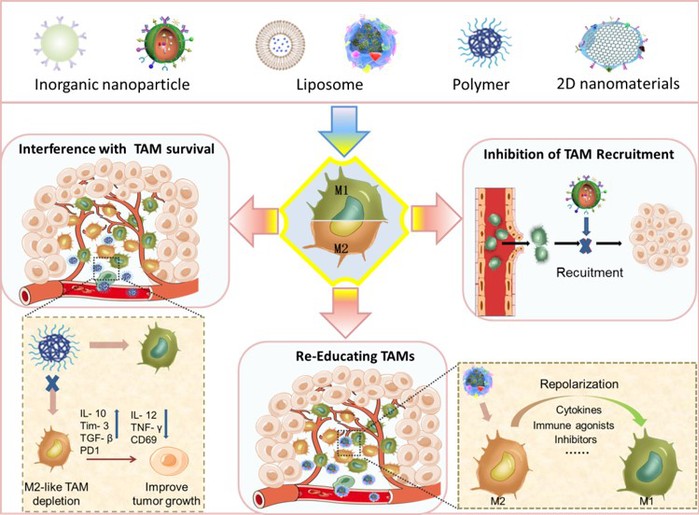
图2 纳米药物针对TAMs,抑制其招募,或干扰生存和重新极化
作者信息:
陈填烽教授团队一直致力于靶向化学创新药物的应用研究,获得万人计划青年拔尖人才项目、国家863计划、国家自然科学基金项目及广东省自然科学杰出青年基金等项目的资助。以通讯作者Cell子刊Matter、Science Advances、JACS、Angew Chem Int Ed、Adv Funct Mater及ACS Nano等IF>10主流杂志发表论文超过45篇,封面论文30篇,h-index 57,申报中国专利55项,实现技术成果转化12项,产生了重要的经济及社会效应,以第一完成人获得2020年中国抗癌协会科技二等奖、2018年中华医学科技奖青年科技奖及2018广东省自然科学二等奖等多项科技奖励。
论文信息:
Li X, Guo X, Ling J, Tang Z, Huang G, He L, Chen T. Nanomedicine-based cancer immunotherapies developed by reprogramming tumor-associated macrophages. Nanoscale. 2021 Mar 12;13(9):4705-4727. doi: 10.1039/d0nr08050k. PMID: 33625411.
论文连接:
https://pubmed.ncbi.nlm.nih.gov/33625411/


