肿瘤突变的低发和肿瘤部位T细胞的缺乏是“冷肿瘤”的典型特征。近年来为了激活机体的抗肿瘤免疫力,将“冷肿瘤”转变为“热肿瘤”的策略引起了广泛的关注。在此,暨南大学陈填烽教授与温州医科大学附属第二医院朱雪琼教授构建了具有免疫原性的核壳状纳米粒子(Au@Se NPs),用纳米硒(SeNPs)封装了金纳米星(AuNSs),以用于光热治疗(PTT)诱导的针对肿瘤生长的有效免疫治疗策略。合理设计的纳米治疗剂可以达到以下目的:(1)提高了AuNSs的热稳定性和光热转化效率;(2)Au@Se NPs吸收的近红外光有效转化为热量,通过促进SeNPs的细胞代谢转化为活性代谢产物,从而增强对宫颈癌细胞凋亡的诱导;(3)SeNPs介导的化学疗法和AuNSs诱导的PTT之间的协同作用可以将肿瘤相关巨噬细胞(TAM)从M2重构为M1表型;(4)Au@Se NPs联合PTT诱导原发性肿瘤热凝不仅激活抗肿瘤免疫反应,也抑制远处肿瘤的生长(Scheme 1)。综上所述,这项研究不仅可以提供一种逆转免疫抑制性肿瘤微环境的有效策略,而且可以为肿瘤免疫治疗的潜在临床应用提供新的见解。

Scheme 1. Rational design of immunogenic nanotherapeutics Au@Se NPs for PTT-triggered immunotherapy involving reprogramming immunosuppression and activating systemic anti-tumor responses.
本文要点:
(1)正如预期的那样,掺入具有更高光热稳定性和转化效率的金纳米星(AuNSs)促进了硒纳米粒子(SeNPs)的解体和转化,从而通过产生更高的热来增强癌细胞的凋亡(Figure 1)。
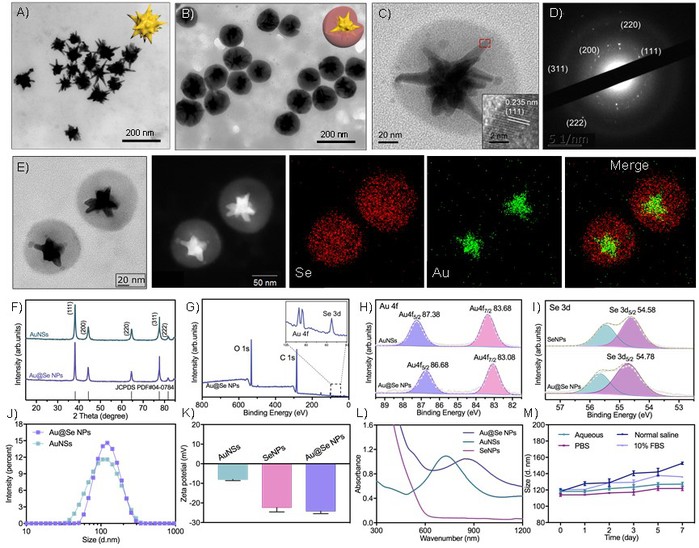
Figure 1. Synthesis and characterization of Au@Se NPs.
(2)体内实验结果表明,SeNPs介导的化疗和AuNSs诱导的光热治疗之间的协同作用不仅能在肿瘤相关抗原存在下产生局部抗肿瘤免疫反应,具有良好的肿瘤杀伤效果,而且能有效地将肿瘤相关巨噬细胞(TAMs)从M2表型重新编程为M1表型,具有吞噬远端肿瘤的抑瘤活性(Figure 2)。
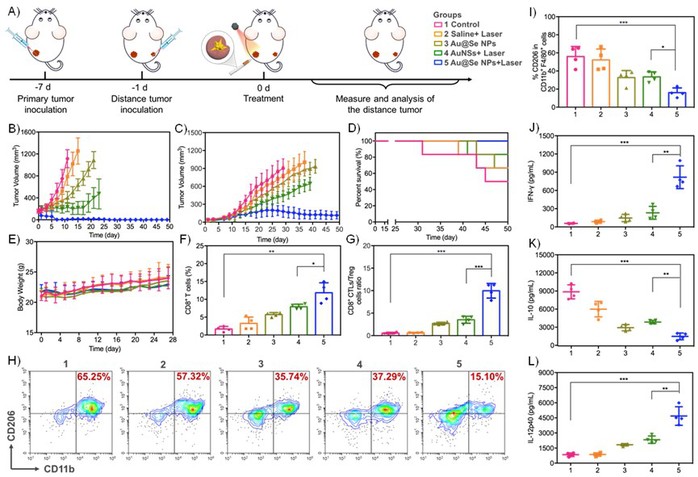
Figure 2. Anticancer effect of Au@Se NPs-mediated PTT against distant tumor.
基金资助
该研究得到了国家自然科学基金委(81974282, 21877049, 21701051),广州市产业技术重大攻关计划(201902020013),广东省促进经济高质量发展专项资金海洋经济发展项目(GDOE[2019]A31),广州市分子与功能影像临床转化重点实验室(201905010003),广东普通高校创新团队项目(2019KCXTD008)的支持。
通讯作者:
陈填烽教授团队一直致力于肿瘤靶向化学创新药物与多模态精准诊疗应用的研究,获得万人计划青年拔尖人才项目、国家863计划、国家自然科学基金项目等项目的资助。在Cell子刊Matter、Science Advances、J Am Chem Soc、Angew Chem Int Ed、Adv Funct Mater及ACS Nano等本领域主流杂志发表论文超过200篇, h-index 59,申报中国/国际专利60项,实现技术成果转化12项。以第一完成人获得2020年高等学校科学研究优秀成果奖技术发明二等奖、2020年中国抗癌协会科技二等奖、2018年中华医学科技奖青年科技奖、2018广东省自然科学二等奖等科技奖励,推动了纳米生物医药领域的创新发展。
论文信息:
Wang, Jing#; Chang, Yanzhou#; Luo, Hui; Jiang, Wenxiao; Xu, Ligeng; Chen, Tianfeng*; Zhu, Xueqiong*, Designing immunogenic nanotherapeutics for photothermal-triggered immunotherapy involving reprogramming immunosuppression and activating systemic antitumor responses, Biomaterials, 2020, 255,120135.
论文链接:
https://doi.org/10.1016/j.biomaterials.2020.120153


