目前,癌症仍然是人类的头号杀手,给个人家庭及经济社会带来了沉重的负担。其中,黑色素瘤由于其高死亡率,预后难度大效果差等特征,受到了科学家们的重点关注。这与黑色素瘤肿瘤微环境的乏氧环境进而导致放疗的耐受性有关。普遍认为,肿瘤微环境与肿瘤的发生发展密切相关,而氧化还原动态平衡是肿瘤微环境的重要特征。因此,合理设计开发既能克服肿瘤乏氧环境,也能有效打破肿瘤微环境氧化还原稳态的纳米体系是实现放疗增敏、高效杀伤肿瘤细胞的有前途的策略。高效低毒是肿瘤治疗领域科学家们孜孜不倦的追求,开发具有肿瘤靶向性的综合治疗平台具有更加广阔的应用前景。

本课题组最新研究成果发表在著名学术期刊Biomaterials(影响因子:15.304)上,题为“In situ-transition nanozyme triggered by tumor microenvironment boosts synergistic cancer radio-/chemotherapy through disrupting redox homeostasis”的论文。暨南大学附属第一医院和暨南大学化学与材料学院为该研究的第一完成单位,硕士生袁中文与刘欣欣为本论文共同第一作者,暨南大学附属第一医院的贺利贞研究员,暨南大学陈填烽教授为该论文的共同通讯作者。
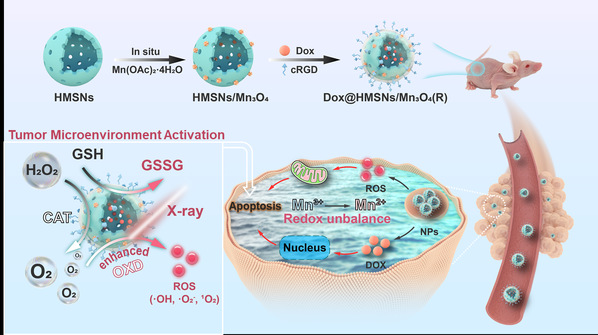
在本研究中,我们探索了一种新的原位合成策略,在中空介孔二氧化硅纳米颗粒(HMSNs)通道中原位生长Mn3O4纳米颗粒(具有产氧能力和打破氧化还原稳态能力),随后将其负载化疗药物阿霉素(DOX)并通过RGD靶向多肽的功能化修饰,构建了肿瘤微环境响应的纳米酶(DOX@HMSN/Mn3O4(R))。该纳米酶能够催化肿瘤微环境中过量的H2O2转化O2,进而增强放疗的抗癌活性。另外,该纳米酶具有较高的类氧化酶活性,促进羟基自由基产生。同时可以通过Mn3+/Mn2+ 的原位转化实现肿瘤微环境中过量的谷胱甘肽消耗,扰乱氧化还原平衡,最终实现高效肿瘤细胞杀伤。最终,在联合DOX及X射线后实现了高效低毒的肿瘤治疗效果。总的来说,本研究为开发具有在肿瘤微环境中原位催化产氧以及打破氧化还原平衡能力的纳米酶材料提供了一种可行的范例,为开发肿瘤放化疗综合治疗平台提供新的策略。
陈填烽,暨南大学教授,国家杰出青年基金获得者、万人计划青年拔尖人才、国家863青年科学家、教育部新世纪优秀人才、霍英东青年教师奖获得者、广东省杰青/特支计划入选者。现任化学与材料学院副院长,附属第一医院纳米诊疗研究所所长、广东省纳米化学创新药物工程技术研究中心主任。研究方向为硒纳米医学与疾病精准诊疗应用。相关研究成果在Signal Transduction and Targeted Therapy、Cell子刊Matter、Sci Adv、J Am Chem Soc、Angew Chem Int Ed、Adv Funct Mater、Biomaterials等本领域IF>10期刊发表论文85篇,封面论文40篇,h-index 73,连续三年入选“中国高被引学者”榜单;2021、2022年入选全球顶尖10万科学家榜单。申报中国专利92项,授权国家发明专利23项,实现技术成果转化13项,实现了纳米硒GMP吨级生产,并开展多中心临床研究。以第一完成人获得2020年高等学校科学研究优秀成果奖技术发明二等奖、2020年中国抗癌协会科技二等奖、2018年中华医学科技奖青年科技奖、2018广东省自然科学二等奖等科技奖励。
原文信息:Zhongwen Yuan#, Xinxin Liu#, Jiabao Ling a, Guanning Huang a, Jiarun Huang a, Xueqiong Zhu b, Lizhen He*, Tianfeng Chen*. In situ-transition nanozyme triggered by tumor microenvironment boosts synergistic cancer radio-/chemotherapy through disrupting redox homeostasis. Biomaterials2022, DOI:10.1016/j.biomaterials.2022.121620.
原文链接:https://doi.org/10.1016/j.biomaterials.2022.121620


