暨南大学陈填烽教授课题组设计合成一种细胞膜仿生二维硒化钼(MoSe2)纳米片,提高其血液相容性,实现高效光热治疗,同时激活细胞毒性T淋巴细胞,诱导肿瘤相关巨噬细胞转化为具有杀瘤能力的M1表型,并联合肿瘤免疫检查点抑制剂PD-1抗体,阻断PD-1/PD-L1信号通路避免肿瘤免疫逃逸,最终清除肿瘤细胞,阻止肿瘤复发。该论文于近日作为封面文章发表在Advanced Functional Materials。

机体免疫系统具有免疫监视功能,本应通过免疫机制排除异己,但是肿瘤细胞却能逃避宿主免疫系统监视和攻击,致使免疫细胞丧失杀伤功能,最终导致肿瘤细胞在体内不断增殖和迁移。肿瘤细胞利用抑制免疫细胞杀伤功能的作用机制,建立起一个肿瘤免疫抑制微环境。该微环境和肿瘤细胞之间的相互作用不仅促进肿瘤生长、转移,更促进了肿瘤细胞的免疫逃逸。近年来,免疫治疗作为一种新兴治疗方式,与常规肿瘤治疗联合能够重新启动机体正常的抗肿瘤免疫反应,从而特异、持续的识别并清除全身肿瘤细胞,阻止肿瘤转移与复发。肿瘤免疫治疗主要包括过继性细胞治疗、单克隆抗体类免疫检查点抑制剂、癌症疫苗、治疗性抗体和小分子抑制剂等。研究发现,肿瘤消融治疗(包括热疗、光动力治疗和冷冻消融等)在杀伤局部肿瘤细胞的同时,会导致肿瘤相关抗原的释放和表达增加,进而激活特异性T淋巴细胞免疫应答,激活肿瘤免疫治疗。
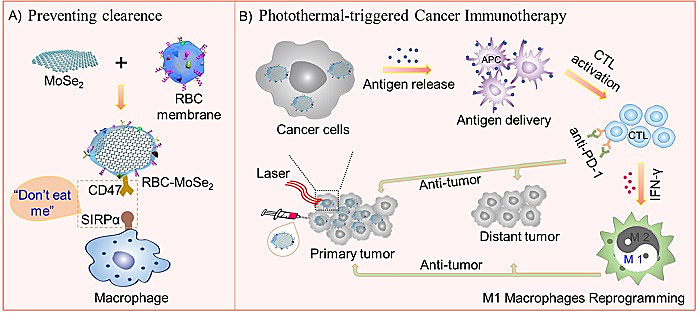
团队采用液体剥离法制备了具有高光热转换效率的二维MoSe2纳米片,针对光热触发肿瘤免疫应答这一特性,将红细胞膜包覆在其表面,利用红细胞膜表面表达整合素相关蛋白CD47,被巨噬细胞表面信号调节蛋白α(SIRP α)特异性识别并结合,从而传递一种“别吃我(Don't Eat Me)”的信号而避免被巨噬细胞吞噬。这种纳米材料的仿生设计能有效的提高纳米材料的血液相容性,降低免疫原性,延长血液循环时间,提高药物利用度。此外,利用MoSe2高效的光热转化效率,在近红外辐射诱导下,将肿瘤细胞热消融的同时,释放出肿瘤相关抗原,并被抗原呈递细胞捕获,激活细胞毒T淋巴细胞,进一步诱导肿瘤相关巨噬细胞转化为具有杀瘤能力的M1表型。此外,联合免疫检查点抑制剂PD-1抗体,阻断PD-1/PD-L1信号通路的激活,避免免疫细胞失活甚至衰竭,同时阻止抗凋亡信号向肿瘤细胞的传递。
总体而言,该研究提供了一种利用仿生二维纳米材料实现高效光热消融肿瘤细胞进而触发全身肿瘤免疫应答的新策略,最终实现肿瘤细胞的清除,阻止肿瘤复发,为肿瘤的综合治疗提供重要的科学依据。相关结果发表在Advanced Functional Materials 上。贺利贞副研究员及博士研究生聂天奇为本论文共同第一作者。相关工作得到了国家万人计划、国家自然科学基金项目等多个项目的资助。


